“战疫中,速响应”系列策划报道——
从4到15,政企协力,核酸检测试剂供应跑出“中国速度”
尹莉娜
目前,新冠肺炎疫情在多个国家出现,检测试剂的供应再次成为焦点。3月6日,科技部社会发展科技司司长吴远彬在国务院联防联控机制举办的新闻发布会上表示,当前,国际社会加强对新冠疫情的科技合作十分重要和紧迫,我国已经向巴基斯坦、日本、非盟等提供了检测试剂。
截至3月6日,国家药品监督管理局已批准新冠病毒检测试剂15款。其中,之江生物、圣湘生物、华大基因等多家企业近期宣布,其研发的新型冠状病毒检核酸测试剂盒获得了欧盟CE认证。这代表着,由我国研发生产的新冠病毒核酸检测试剂盒可以为国际“战疫”提供有力支持。
从起初的供应不足“一盒难求”,到产能恢复日检万份,再到捐赠他国远供海外,疫情期间,“核酸检测试剂盒”一词几乎成为“中国速度”的新名片。在短短一个多月内扭转局面响应需求,中国是如何做到的?本网“复盘”这一过程发现,其背后是一场由政府监管部门、试剂研发生产商、原料供应商、第三方检测平台等全行业共同参与,与一线医疗机构配合“战疫”的加速赛跑。

实验室人员正在进行核酸检测操作环节
体外诊断行业迎临时大考
核酸检测“金标准”首当其冲
早诊断,才能早治疗。无论此前的传染性非典型肺炎(SARS)、中东呼吸综合征(MERS),还是此次新型冠状病毒感染的肺炎,每当有疫情爆发,诊断试剂的需求总是第一位的。
但不同的是,诊断技术在进步。核酸检测是一种体外诊断中的分子诊断方法,由于特异性高等特点,在医学界被认为是传染病的病原学检测的“金标准”,也成为是此次疫情中最早开始使用的主要诊断方法。由国家卫生健康委印发的《新型冠状病毒肺炎诊疗方案》日前已修订更新至试行第七版,其中,“实时荧光RT-PCR检测新型冠状病毒核酸阳性”,始终被列为确诊病例的关键条件。
解放军总医院医学检验中心主任、中华医学会检验医学分会主任委员王成彬表示,新型冠状病毒肺炎是由2019新型冠状病毒(2019-nCoV)感染引起的一种急性传染性疾病,而确定诊断的“金标准”就是在患者体内找到2019-nCoV。核酸检测就是检测2019-nCoV基因中某些特定核酸序列的存在,因此从方法学层面考虑,其作为实验室诊断“金标准”没有任何疑问。
因而,在疫情发生后,研发生产出针对新型冠状病毒的核酸检测试剂盒是当务之急。中国医疗器械行业协会体外诊断分会理事长、全国卫生产业企业管理协会医学检验分会副会长朱耀毅告诉本网,自上世纪90年代起,中国的分子诊断,特别是PCR(聚合酶链式反应)检测技术发展迅猛,目前研发、生产、营销等各方面的总体水平在全球市场中处于前列。也就是说,在技术层面上,我国有能力和水平实现这一任务。
通常,一款该类产品从研发、审批、生产到上市应用,平均来说,整个过程至少需要3年时间。要在春节年关之际、短时间内研发生产出新型产品,是对于整个体外诊断行业的一次临时“大考”。
“首先,试剂研发商必须在疫情发生早期,就关注到新发疾病的相关信息,并快速反应作出决策;其次,核酸检测试剂盒的设计需要相应的探针和引物,这意味着,上游原料供应商要在春节假期间保障高质量原料的足量应急供应;与此同时,产品研发过程中还要与一线医疗机构合作进行验证,有越多数量的临床标本进行验证,检测试剂盒的特异性和敏感度就越高。”朱耀毅分析谈到。
此外,产品研发后,能否通过审核注册也是一道“槛”。按照风险程度,核酸检测试剂盒属于级别最高的第Ⅲ类医疗器械,一般由国家药品监督管理局(以下简称国家药监局)实行产品注册管理,审批流程十分严格。简而言之,能否及时交上这份核酸检测试剂的“答卷”,取决于业内多方面的配合。
新型冠状病毒COVID-19核酸检测试剂盒
一周内上市7款核酸检测试剂盒
研发、审批、生产,全行业全力加速
1月21日,春节在即,国家药监局紧急启动了《医疗器械应急审批程序》,此后的十多天里,医疗器械技术审评中心开始了紧锣密鼓的连续加班,本着“统一指挥、早期介入、随到随审、科学审批”的原则,对相关入选企业及其新型冠状病毒核酸检测试剂产品展开指导和审评,支持科研生产。
而检测试剂的研发工作则是在更早之前,几乎与疫情的发现同时展开。2019年12月31日,武汉市首次公开通报出现“不明原因肺炎病例”,当晚,国药集团中国生物旗下从事新发和常见传染病的分子检测企业,上海捷诺生物科技有限公司派出3名技术工作者乘最早班航班抵达武汉开展检测,用多重病原诊断试剂检测结果,排除现有已知病原感染,为考虑和发现新型病毒感染提供了思路。
多家诊断试剂行业的高新技术企业都作出了快速反应。根据此前在多起历史公共卫生事件中曾提供技术支持的经验,华大基因在2020年1月初紧急组织科研及生产力量,开始研制相关试剂盒。据介绍,由于新型冠状病毒与蝙蝠类SARS病毒的同源性较高,为确保准确鉴定,避免形成交叉误判,必须设计出针对该病毒的特异检测试剂盒。争分夺秒之下,历时72小时后,华大团队完成了初步研发。
最终,在国家药监局的层层严格审核之下,1月26日,上海捷诺生物科技有限公司、华大基因旗下的华大生物科技(武汉)有限公司和武汉华大智造科技有限公司,以及上海之江生物科技股份有限公司4家企业的4个新型冠状病毒检测产品通过了国家药监局应急审批,投入生产应对疫情需要。
到1月31日,不足一周时间内,共计7家企业的7款新型冠状病毒2019-nCoV核酸检测试剂盒和1款配套分析软件陆续通过获批。此后,随着疫情转入新阶段,研发和审批工作仍在进行。截至目前,已有13家企业的15款检测产品通过应急审批注册上市。
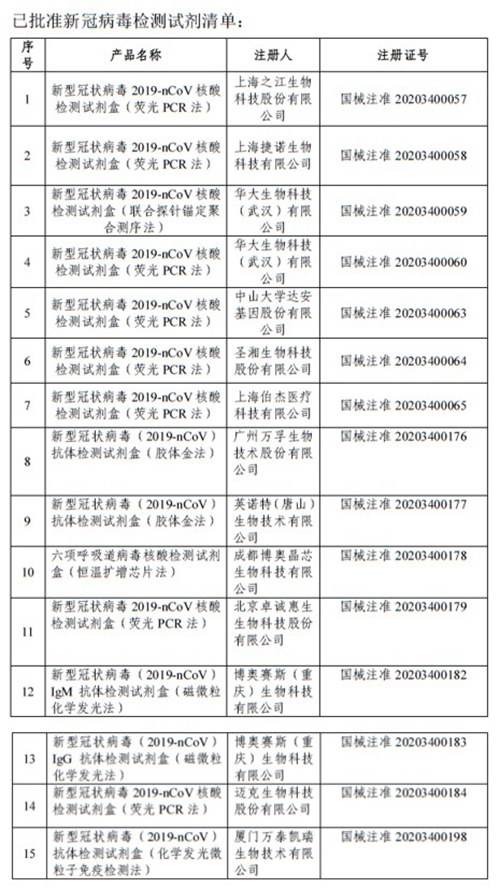
国家药品监督管理局网站截图
产品获批后,为保证试剂盒供应,相关企业纷纷加紧扩产,到2月1日,工业和信息化部相关数据显示,新冠病毒核酸检测试剂盒的日产量已经达到了77.3万人份,约等于当时疑似患病者的40倍。
多重因素影响检出率
多方力量支援提升检测能力
随着产能的恢复,核酸检测试剂盒的供应有了保障,但“战疫”路上的每一步,始终都需要众志成城,协力前行。核酸检测能否准确、快速完成,除了检测试剂,还取决于诸多原因。
一方面,病毒的检出率受多重因素影响。北京大学人民医院呼吸内科主任高占成在国务院联防联控机制新闻发布会上表示,任何病毒核酸检测的检出率都不可能是百分之百,出现假阴性不可避免,同时检出率还可能与患者病情轻重程度、病程发展阶段、样本取材和实验室检测条件等多种因素有关。
解放军总医院医学检验中心主任、中华医学会检验医学分会主任委员王成彬也谈到,根据核酸检测的方法学特点,疾病发展过程、标本采集、标本保存与运输、核酸提取、扩增体系、人员操作等因素都可能造成最后检测结果的假阴性或假阳性。
另一方面,由于新冠病毒的检测对于实验室、检测人员和个人防护的要求均较高,样本处理的速度也制约着检测效率。“从采集标本送到实验室,经过对标本的接收、处理、病毒核酸提取、核酸扩增、数据处理及报告,一般需要约4个小时或更长时间。”王成彬谈到。而对于不具备相关条件或疫情较重的地区而言,还需要加上本样的运输和等待处理等过程,患者的等待时间就远远拉长。
为提高重点疫区的检测能力,中国疾控中心和17个省份83位实验室检测人员增援湖北省,以外部“输血”弥补了检测人力的不足。同时,湖北省也先后分五批扩充了核酸检测机构数量,除了医疗机构和疾控中心外,还有多家社会第三方检测机构加入。

武汉“火眼”实验室
2月5日,新型冠状病毒应急检测实验室——“火眼”实验室正式在武汉启动试运行,这是由武汉市政府、东湖高新区、中交二航局、上海诺瑞实验室、华大基因多方联合共建的第三方检测实验室,每日可检测万人份样本。此外,根据湖北省卫健委网站公示的第三方检测机构名单,包括迪安医学、平安好医生、金域医学等在内的13家企业都可开展新型冠状病毒核酸检测。
随着检测能力的显著提高,2月22日,好消息再次传来——“武汉核酸检测存量清零了!”连日来,数十家核酸检测机构同时开工,实现了全市临床确诊、疑似、密切接触者、发热患者“四类人员”的核酸检测存量全面清零。
在满足国内需求的同时,我国研发生产的核酸检测试剂正在国际“战疫”中发挥作用。官方消息显示,我国已经向巴基斯坦、日本、非盟、伊朗等多个国家和地区提供了检测试剂。而据行业媒体不完全统计,截至3月5日,国内已有之江生物、圣湘生物、华大基因等7家企业宣布其新冠病毒核酸检测试剂盒获得欧盟CE认证,接下来将进一步向国际供应。
在新冠疫情这场突如其来的大考中,“中国速度”一刻都不曾松懈,而“核酸检测试剂盒”正在成为它的新名片。
 人民健康APP
人民健康APP 人民好医生APP
人民好医生APP
热门点击排行榜
联系我们
|
人民健康网微信
微信号:rmwjkpd 公众号:人民网健康 |
人民健康网微博
微博昵称: 人民网健康卫生频道 |
|
电话:010-65367951 邮箱:health@people.cn | |



